
手機掃碼訪問本站

微信咨詢
分裂、傳代和亞培養都是維持健康細胞培養細胞的重要過程。本文將為您提供有關如何傳代細胞、傳代細胞步驟以及可能出現的問題的詳細指出。
在深入研究如何傳代細胞之前,我們需要解釋一下粘附細胞和懸浮細胞之間的區別。
貼壁細胞附著在培養瓶和培養皿的表面。這意味著它們的生長受到培養皿或培養瓶表面面積的限制。這也意味著需要先將它們分離,然后才能將它們重新接種到新的培養皿中。
細胞培養板和培養瓶通常會經過涂層處理,以幫助促進細胞附著在表面。
懸浮細胞不附著,而是自由漂浮在培養基中。因此,它們的生長不受表面積的限制,而是受培養物中細胞密度的限制。懸浮細胞需要攪拌以確保最佳生長和氣體交換,通常在旋轉瓶或搖動培養箱中生長。
由于懸浮細胞不需要從培養瓶中分離出來,因此它們被認為更易于傳代。
表1.懸浮細胞與貼壁細胞的比較:
| 懸浮細胞 | 貼壁 |
|
更容易培養,無需去除所有舊培養基即可稀釋。 |
需要更多步驟進行傳代,需要定期徹底更換培養基。 |
| 不需要機械或化學解離 | 需要用胰蛋白酶消化才能傳代培養,這會給細胞帶來壓力 |
| 不容易確定匯合度需要每日進行細胞計數 | 可以在顯微鏡下輕松檢查以確定匯合度 |
| 細胞濃度限制生長 | 生長受表面積限制 |
您已檢查細胞培養物的融合度,并且它們已準備好傳代。接下來該做什么?傳代貼壁細胞主要有四個步驟:
一、PBS洗滌
在從培養皿中分離細胞之前,重要的是吸出舊的、用過的培養基并用平衡鹽溶液(BSS)沖洗細胞。
為什么需要沖洗貼壁細胞?
沖洗細胞將有助于消除培養基中可能抑制細胞釋放溶液作用的蛋白質和離子。使用BSS是因為它們能保持生理pH值和鹽濃度。
典型的鹽溶液包括:
·磷酸鹽緩沖溶液(PBS)
·漢克斯緩沖鹽溶液(HBSS)
·Earle平衡鹽溶液(EBSS)
在傳代培養細胞時應使用不含鈣和鎂的鹽溶液,因為鈣和鎂都會促進細胞聚集。
二、消化/解離
通過破壞細胞蛋白與培養皿表面的相互作用,細胞可以從培養皿中釋放出來。不同類型的細胞在粘附培養皿底部方面具有不同的特性。一些細胞仍然像小球一樣,幾乎不與培養皿接觸,而另一些細胞則平鋪并覆蓋多層蛋白質,將它們與培養皿結合在一起。
您的目標是使用對每種細胞類型損傷最小的程序將細胞從培養皿中分離出來。您選擇如何將細胞從培養皿中釋放出來將取決于細胞的粘附特性。
選擇1:機械分離
一些輕度粘附的細胞在加入BSS(不含鈣和鎂)后會開始從培養皿中升起。在這種情況下,只需將BSS直接噴灑在細胞上并輕敲培養皿即可去除細胞。
也可以用細胞刮刀輕輕去除松散附著的細胞。
選擇2:EDTA
EDTA是一種螯合劑,可以結合整合素維持細胞粘附所需的Ca 2+離子。EDTA(1-10mM,取決于細胞類型)是將細胞從培養皿中分離出來的較溫和的方法之一,但僅使用EDTA對大多數細胞類型來說不夠有效。
EDTA在預熱至37°C時最有效,但對于非常敏感的細胞,請使用室溫或4°C的EDTA。
選擇3:酶促釋放
蛋白水解酶可用于消化粘附細胞到培養皿的蛋白質。此選項對于傳遞牢固附著的粘附細胞是必需的,因此通常用于傳遞粘附細胞。
然而,需要謹慎,因為蛋白水解消化可能會通過切割細胞表面蛋白來破壞細胞的完整性。治療時間應限制在剛好達到細胞分離所需的時間范圍內,以防止細胞損傷。
對于處理細胞的時間長短沒有硬性規定。處理時間需要根據每種細胞類型根據經驗確定,取決于細胞粘附的強度、細胞培養的時間長度以及培養物的匯合度。
胰蛋白酶是用于傳代細胞的最常用酶。胰蛋白酶在賴氨酸或精氨酸殘基后進行切割,而脯氨酸不會緊隨其后。工作胰蛋白酶濃度范圍為0.025%至0.5%,胰蛋白酶溶液通常用EDTA制成,以增強細胞分離。
3.分離和滅活
為了防止細胞結塊和分布不均,細胞應處于單細胞懸浮狀態。如果不是,向細胞中添加少量液體,然后輕輕地將液體移入和移出5毫升移液器。
有些實驗室會添加加熱的生長培養基,而有些實驗室會添加含有10%胎牛血清(FBS)的BSS。添加加熱的生長培養基或BSS+FBS可使用于從培養皿中分離細胞的試劑失活,并提供更多體積用于移液。
為了完全滅活分離劑,請將細胞收集到大量生長培養基或BSS+FBS中,然后離心細胞。如果將細胞稀釋到大量生長培養基中以便重新接種,并且殘留的胰蛋白酶/EDTA不會影響細胞附著,則可以省略離心步驟。
4、接種
當細胞從培養皿中脫落或處于離心機中時,我通常會設置要將細胞移入的培養皿,標記所需數量的培養皿,并將加熱的生長培養基添加到培養皿中。
細胞分離后,將離心后的細胞重新懸浮在少量生長培養基中,并使用血細胞計數器計數細胞。將細胞稀釋至適當密度,然后分裝到新培養皿中。我喜歡添加足夠的培養基,將1-2毫升移液到每個接收培養皿中。輕輕旋轉和搖動培養皿,使細胞均勻分散在整個培養皿中。
一些細胞,例如我們血液中的造血細胞,自然地懸浮在體液中,不會附著在表面。
培養這些懸浮細胞比培養貼壁細胞要容易一些,因為懸浮細胞不需要胰蛋白酶消化,因為它們已經是自由漂浮的。因此,傳代過程更快,對細胞的壓力更小。
確定懸浮細胞的傳代時間
懸浮細胞通常保存在培養瓶中,每2或3天達到匯合時重新接種。您可以判斷懸浮細胞何時達到匯合,因為它們會開始聚集在一起并漂浮在培養基上;培養基會略微改變顏色并顯得更渾濁。
懸浮細胞傳代涉及兩個主要步驟:
然而,如果細胞已達到高密度且培養基變酸,您可能希望通過添加離心步驟去除舊培養基。
在分離細胞之前,您應該在倒置相差顯微鏡下觀察培養物。健康生長的懸浮細胞應呈圓形且明亮,細胞碎片最少。通過觀察顏色來檢查培養基是否呈酸性:當pH值為酸性時,酚紅會變黃,這表明培養物中的細胞過多。
1.計數細胞
懸浮細胞通常保存在培養瓶中,每2或3天達到匯合時重新接種。如果您正在準備用于實驗的培養瓶,您可能需要先計算細胞數量,以確保您在培養瓶中接種了適當數量的細胞。
計數懸浮細胞與計數粘附細胞相同(在它們分離并重新懸浮之后)。但是,為了確保粘附細胞的計數準確,請在取樣計數之前輕輕移液培養物,以確保培養物分布均勻。
如果您正在分裂細胞以進行維護,則可以跳過計數步驟。
2.稀釋細胞
對于懸浮細胞,并不需要像貼壁細胞那樣真正去除所有舊培養基。相反,可以去除部分舊培養物,然后用新鮮培養基將剩余的培養物稀釋到合適的細胞密度。
或者,可以從舊燒瓶中取出一部分細胞并稀釋到新鮮培養基中。
但是,當您的培養物呈酸性時,建議移除培養基。要移除舊培養基,請以150xg離心5分鐘,移除酸性培養基,輕輕地將細胞沉淀懸浮在溫熱培養基中,然后重新接種到新鮮培養基中。
1.使用前將所有試劑放入37°C水浴中預熱約30分鐘。這將有助于保持細胞健康并避免溫度變化帶來的沖擊。
2.在開始之前設置組織培養罩,確保罩是干凈的,并且您擁有所需的所有設備。這可以縮短傳代細胞所需的時間,并減少因離開培養罩/培養室而造成的潛在污染。
3.在組織培養罩內設立不同的“潔凈區”和“臟區”,并合理設置它們,這樣您就不會將臟設備放在“潔凈區”內。
4.確保始終使用無菌技術,以盡量減少細胞的潛在污染。將試劑從水浴中取出后,不要忘記擦拭試劑,并在將其放入通風柜前用70%乙醇或IMS噴灑試劑。
5.僅使用少量胰蛋白酶釋放細胞(1-2ml/25cm2),并將胰蛋白酶時間保持在釋放細胞所需的最短時間(當細胞剛剛檢測到時)。用力“拍打”培養皿和燒瓶,以幫助在胰蛋白酶消化后釋放細胞。
6.胰蛋白酶化后,向胰蛋白酶和細胞中添加少量加熱的生長培養基,然后用5毫升移液器反復將液體移入和移出,以打碎任何細胞團塊。
7.重新接種細胞(特別是貼壁細胞)時,輕輕搖晃/旋轉培養板以確保細胞分布均勻。詳情見下圖1。
如何傳代細胞:接種后獲得均勻分布的細胞。
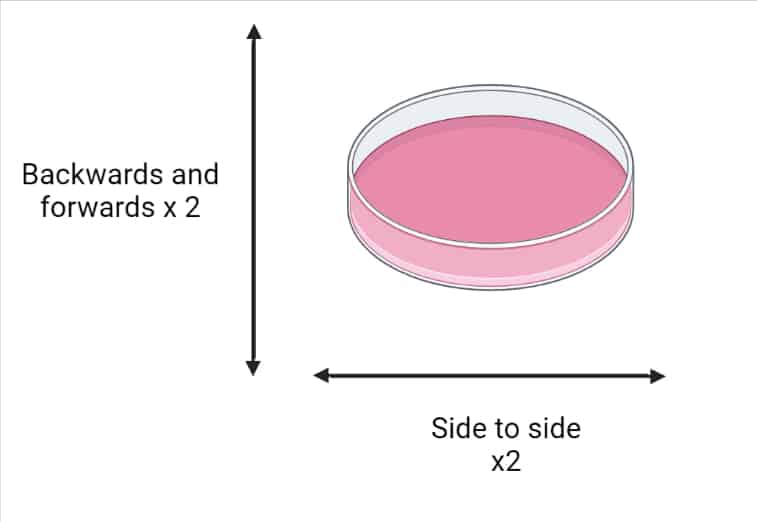
圖1.接種后如何使細胞分布均勻。
8.開始前預先標記培養板,并在細胞進行胰蛋白酶消化時添加溫熱培養基。這可以最大限度地縮短細胞離開培養箱的時間,從而限制環境沖擊和干擾的程度。
9.以1:2至1:10之間的稀釋比例分批細胞。稀釋比例過高,細胞很快就會變得過于擁擠;稀釋比例過低,細胞可能因密度低而無法存活。(細胞也會感到孤獨!)
10.為細胞分裂制定一個時間表(例如,在星期二和星期五)。制定時間表將使你更容易記住傳代培養物,避免細胞過度融合。
11.整理好培養箱,這樣你就能確切地知道哪些細胞在哪里。這可以減少你尋找培養物的時間。長時間打開培養箱門可能會改變環境,影響細胞的生長和正在進行的實驗。
好了,上述是細胞傳代概述,無論你培養哪種細胞類型,分裂細胞時都應準確、無菌且快速,以盡量減少污染和對培養物的壓力。做好準備和組織起來也有助于縮短分裂細胞所需的時間。
 QQ:2881498722
QQ:2881498722  手機號碼:15800441226
手機號碼:15800441226 服務電話:021-54721350
服務電話:021-54721350 E-mail:2881498722@qq.com
E-mail:2881498722@qq.com 公司地址:上海市金山工業區亭衛公路6558號9幢2447-12室
公司地址:上海市金山工業區亭衛公路6558號9幢2447-12室